Nueva estrategia “prometedora” para la ELA con células madre creadas a partir de pacientes
Investigadores de EE. UU. han utilizado células madre creadas a partir de pacientes con un tipo muy raro de ELA, más prevalente en Brasil, para atacar un gen clave en la respuesta al estrés y revertir en el laboratorio el daño sufrido por las neuronas motoras. Creen que es “una prueba de concepto prometedora para futuras estrategias terapéuticas” y “podría ayudar a sentar las bases para ensayos clínicos con información genética”.

Adolfo López de Munain - ELA Brasil
Adolfo López de Munain
Jefe Clínico de Neurología del Hospital Universitario de Donostia, director científico del CIBERNED y director de Investigación del área de Neurociencias del ISS Biodonostia
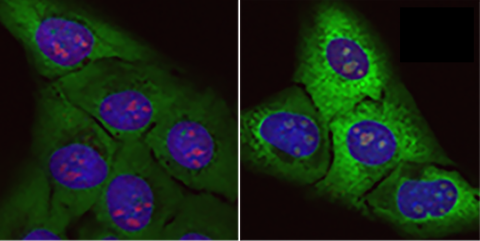
El estudio es sólido y se basa en el estudio en células derivadas de iPS [células madre pluripotentes inducidas] de pacientes con esta mutación en el gen VAPB. Esta aproximación tiene sus limitaciones, ya que es una recreación artificial de lo que ocurre in vivo, pero es una buena aproximación para dilucidar aspectos mecanísticos.
Este estudio pon en evidencia tres cosas:
-
Que la ELA no es una entidad homogénea desde el punto de vista fisiopatológico y que, en este caso, el papel fundamental que lleva a la neurodegeneración de la motoneurona está en las conexiones entre la mitocondria y el retículo endoplásmico (MAMs).
-
Que existe, como consecuencia de la disfunción de estas estructuras, una alteración de la respuesta integrada al estrés.
-
Que ello puede llevar a aproximaciones terapéuticas con inhibidores de esta IRS como el ISRIB o similares. A este respecto hay trabajos previos de investigadores españoles (Bugallo et al.) que ya apuntaban en esta dirección.
Las limitaciones vienen derivadas del modelo. Los autores estudian esto en motoneuronas derivadas asumiendo que este trastorno se produce in vivo en estas células, obviando que es posible que existan mecanismos similares en células de soporte de la glía. Sería importante analizar el efecto de la mutación en células musculares y de la glía para ver el efecto mediante mutación condicionada en una única estirpe celular en otros modelos animales.
Este hallazgo abre la puerta a desarrollar fármacos con esta diana y también a intentar analizar en contexto clínico cual es el peso de este mecanismo en casos de ELAs esporádicas de cara a estratificar los pacientes en los ensayos. Desgraciadamente, en la ELA esporádica confluyen diversos mecanismos y desconocemos el peso individual de cada uno de ellos y su secuencia cronológica en pacientes concretos, lo que dificulta el poder establecer un plan terapéutico adaptado al contexto real de cada paciente. Para avanzar en la medicina de precisión de la ELA debemos poder ponderar mediante biomarcadores vinculados a cada mecanismo la situación real de cada paciente.
Juan Alberto Ortega Cano - ELA Brasil
Juan Alberto Ortega Cano
Profesor investigador Ramón y Cajal, departamento de Patología y Terapéutica Experimental, Facultad de Medicina y Ciencias de la Salud
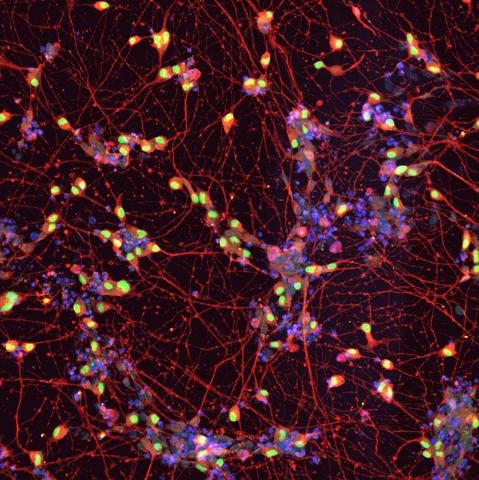
El trabajo recién publicado por Landry et al. se centra en una forma familiar de esclerosis lateral amiotrófica (ELA), la más común en Brasil, utilizando modelos de neuronas motoras derivadas de iPSC [células madre pluripotentes inducidas] humanas. Es un estudio clásico y robusto, en donde inteligentemente se utilizan métodos genéticos para estudiar el efecto en neuronas motoras de la proteína mutada en los pacientes, VAPB, en su forma “sana” o mutada (P56S) asociada a la ELA tipo VIII. Por lo general, las conclusiones están bien respaldadas por datos sólidos que incluyen análisis funcionales, moleculares y morfológicos, así como rescate fenotípico mediante inhibición farmacológica de la respuesta integrada al estrés (ISR).
Entre los fenotipos patológicos que se observan en las motoneuronas que expresan exclusivamente la forma mutante, se encuentra la reducción en la unión entre retículo endoplasmático y mitocondria, reducción en el potencial de membrana mitocondrial y en actividad eléctrica de las motoneuronas. Los autores integran coherentemente la evidencia existente sobre el rol de VAPB en la unión entre retículo endoplasmático y mitocondria y el papel emergente de la ISR en neurodegeneración. La novedad del estudio es la asociación directa que hace entre la disfunción mitocondrial, mutación-específica, por la reducción en su contacto con el retículo endoplasmático, y una mayor activación de la ISR. Algunos de estos fenotipos (no el electrofisiológico) se han observado también en neuronas motoras derivadas de iPSC obtenidas de pacientes (con la mutación en heterocigosis) comparándolos con controles donde se corrige genéticamente la mutación. Esto corrobora que en los pacientes también se pueden dar estos defectos.
Queda por entender cómo, mecanísticamente, la reducción en el contacto entre retículo endoplásmico y mitocondria causada por la mutación genera mayor estrés en estos compartimentos, lo cual lleva a una activación más elevada de la ISR. De hecho, el rol de la ISR en ELA ha sido estudiado en los últimos años en múltiples formas familiares de la enfermedad. Según los autores del estudio, parece ser que, en las diferentes formas de ELA, la activación elevada de la ISR puede tener un efecto positivo y negativo. Con lo cual, la utilización de fármacos que modulen al alza o a la baja esta vía dependerá del tipo de paciente de ELA. De hecho, dos ensayos clínicos citados en el artículo, y que potencian la activación de la ISR, han fallado ya en fases iniciales.
Entre las limitaciones, se reconoce que los resultados se centran en un subtipo genético específico de ELA, que representa un porcentaje muy bajo de pacientes (<1%) lo cual restringe la generalización inmediata a otros subtipos. Además, aunque se demuestra reversión fenotípica con un inhibidor de la vía de ISR, no se explora completamente si el tratamiento puede detener o revertir la degeneración neuronal en etapas avanzadas.
Las implicaciones clínicas son claras: este trabajo apoya el estratificado tratamiento de la ELA en función de la genética del paciente, y propone la modulación de la ISR como una diana terapéutica viable en subgrupos específicos. Esto es especialmente relevante tras el fracaso de ensayos clínicos con inhibidores de ISR en poblaciones no estratificadas. Además, se deberá estudiar en profundidad cómo estos tratamientos pueden corregir la degeneración de las neuronas motoras sin afectar a cómo lidian con el estrés celular el resto de las células del cuerpo.
David Pozo Pérez - ELA Brasil
David Pozo Pérez
Catedrático de Bioquímica y Biología Molecular de la Universidad de Sevilla, investigador principal en CABIMER (CSIC-US) en el Laboratorio de Neuroinmunología Celular y Molecular
La investigación liderada por un equipo de la Case Western Reserve University en Cleveland (Ohio, EE. UU.) ha identificado los efectos desde el punto de vista molecular que causa la mutación P56S en el funcionamiento de la motoneurona. Ligan este efecto con respuestas inadecuadas de las neuronas a un entorno en el que haya situaciones de estrés y en el que las interacciones entre la mitocondria y el retículo endoplásmico puedan jugar un papel relevante. Esta mutación está relacionada con un subtipo de ELA poco frecuente, denominada ELA Tipo VIII, que se caracteriza por su aparición temprana (en la treintena de edad) y tener un progreso muy lento de afectación motora.
El trabajo es relevante porque identifica mecanismos de acción, algo que es fundamental para poder establecer estrategias racionales de intervención farmacológica. Las limitaciones desde el punto de vista de traslación de los resultados son varias. La más importante es que todos los resultados están realizados in vitro y, por tanto, la aportación de otros tipos celulares al inicio y establecimiento de este tipo de ELA no se contextualiza. La ausencia de estudios preclínicos en modelos humanizados sería de gran valor añadido. Los estudios moleculares que nos ayudan a entender cómo las neuronas gestionan situaciones de estrés son fundamentales, si bien aún desconocemos el origen, dinámica y efectos de las causas que generan estas situaciones.
Si algo sabemos en relación con los mecanismos patológicos de la ELA es que no es una entidad única y que el diálogo entre diversos tipos celulares es fundamental para entenderla y, por tanto, gestionarla clínicamente en un futuro.
Alberto García Redondo - ELA células madre
Alberto García Redondo
Investigador en GenELA - Laboratorio de Diagnóstico Genético e Investigación en ELA, Hospital Universitario 12 de Octubre, Instituto de Investigación Sanitaria Hospital 12 de Octubre, Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER)
El estudio es de muy buena calidad, y está respaldado por datos susceptibles de ser replicables… lo cual no sé si es suficientemente sólido o no.
Se trata de un estudio muy específico, realizado en un modelo celular derivado de pacientes (IPSCs) y todos sabemos que estos modelos son poco reproducibles. Lo cual no lo invalida, sino que debemos considerar que su reproducibilidad está en cuestionamiento de cara a mayor profundización en los resultados.
En principio, encaja bastante bien con la evidencia existente. Ofrece datos relativamente novedosos sobre la funcionalidad de una proteína que es codificada por el gen VCP. Este gen da lugar a un porcentaje bajísimo de ELAs Familiares que se circunscriben específicamente a Brasil y otros países de habla portuguesa (se ha descrito alguna familia en Mozambique). En torno al 0,01-0,05 % de los pacientes con ELA (o incluso inferior).
Eso sí, los datos que ofrece sobre cómo se altera el proceso de interacción entre retículo endoplasmático y mitocondria ofrecen nuevos datos sobre un punto débil en las neuronas motoras, que de algún modo podría dar lugar a su degeneración y al proceso neurodegenerativo en la ELA. Y, por lo tanto, cómo el mecanismo de la Respuesta Integrada al Estrés (ISR) se altera en este tipo de neurodegeneración.
Todo esto da nuevas ideas para iniciar novedosos caminos que lleven al desarrollo de plausibles terapias en un futuro más bien lejano. Y que, sin duda, serán terapias probablemente dedicadas a un subgrupo muy concreto de pacientes.
[Sobre sus limitaciones]
Los resultados del estudio son en sí mismo confusos. Por un lado porque el modelo utilizado no es muy reproducible y, sobre todo, por un segundo lado porque los resultados son aparentemente alagüeños, y lo único que demostrarían (en caso de que sea todo lo comprobado reproducible a largo plazo, y en otros modelos in vivo) es una nueva vía de iniciación y desarrollo del proceso neurodegenerativo en la ELA.
[Sobre las implicaciones para el mundo real, para la clínica]
En el momento actual, ninguna. De cara a un futuro, desgraciadamente lejano, se podrán probar algunos tipos de terapias dirigidas a este nuevo mecanismo supuestamente asociado a la ELA, que probablemente podrían (siempre en condicional, pues son hipótesis de futuro) dar resultados en subgrupos muy concretos y pequeños de pacientes.
- Artículo de investigación
- Revisado por pares
- Estudio experimental
- In vitro
Landry et al.
- Artículo de investigación
- Revisado por pares
- Estudio experimental
- In vitro