Corrigen con edición genética mutaciones dañinas en el ADN mitocondrial humano
Un equipo de los Países Bajos ha conseguido editar mutaciones patogénicas del ADN mitocondrial en células humanas, unos cambios del ADN que causan enfermedades, según detalla una investigación publicada en PLoS Biology. Los autores han utilizado una herramienta genética conocida como editor de bases. Hasta ahora, técnicas derivadas de CRISPR han permitido corregir mutaciones en el ADN del núcleo y se están desarrollando nuevas técnicas que permiten editar ADN de la mitocondria.
Santiago Restrepo - edición ADN mitocondria
Santiago Restrepo Castillo
Investigador posdoctoral en la Universidad de Texas en Austin (EE.UU.)
El material genético (ADN) en nuestras células es como un complejo “manual de instrucciones” que define las funciones de nuestro cuerpo al nivel molecular. Errores en este manual (mutaciones en el ADN) pueden generar enfermedades genéticas, las cuales pueden ser fatales. El desarrollo de tecnologías para la corrección precisa y eficiente de estas mutaciones es esencial para el establecimiento de terapias genéticas. En la última década, ha habido grandes avances en la corrección terapéutica de mutaciones en el ADN localizado en el núcleo de las células humanas, principalmente utilizando tecnologías derivadas de CRISPR, una plataforma que recibió el Premio Nobel de Química el 2020. Sin embargo, el material genético resguardado en las mitocondrias no ha sido tan fácil de operar.
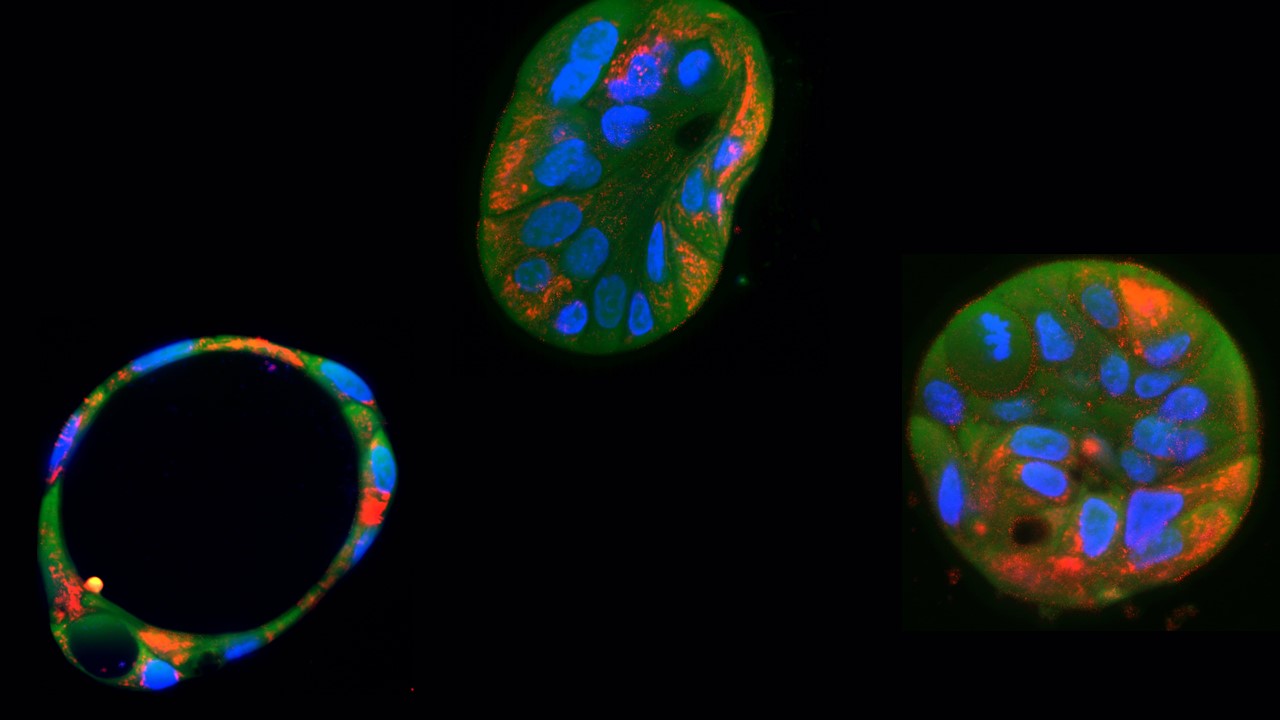
Basados en desarrollos previos de tecnologías alternativas a CRISPR para la edición precisa del ADN mitocondrial, los autores de este estudio demostraron por primera vez la utilidad de estas herramientas en organoides (cultivos celulares tridimensionales), los cuales pueden ofrecer información esencial en estudios preclínicos. Adicionalmente, los autores corrigieron una mutación del ADN mitocondrial en células derivadas de pacientes, una estrategia que ha sido explorada en otros estudios, pero que demuestra aún más el potencial terapéutico de los editores de bases de ADN mitocondrial. Finalmente, los autores exploraron el eje traslacional de su investigación demostrando por primera vez la entrega de estos editores en nanopartículas lipídicas, una estrategia prometedora para la transferencia terapéutica de estas herramientas.
Este estudio representa una prometedora prueba de concepto, la cual será complementada por nuevos avances y aplicaciones de editores de ADN mitocondrial en nanopartículas lipídicas, particularmente para el desarrollo de terapias genéticas personalizadas utilizando organoides derivados de pacientes con diferentes mutaciones mitocondriales.
250623 ADN mitocondrial Lluis ES
Lluís Montoliu
Investigador en el Centro Nacional de Biotecnología (CNB-CSIC) y en el CIBERER-ISCIII
La microbióloga Lynn Margulis pasará a la historia de la biología por haber propuesto la teoría endosimbiótica del origen de las células eucariotas (las que forman el cuerpo de levaduras, hongos, plantas y animales) por la cual diferentes bacterias se organizaron y aprendieron a vivir conjuntamente, en simbiosis. Una de ellas dio lugar al orgánulo subcelular que hoy conocemos como mitocondria, que acabó especializándose en producir la energía que necesitaba la célula para sobrevivir.
Las mitocondrias, debido a su origen bacteriano, tienen un genoma propio, muy simplificado ya, tras miles de millones de años de evolución, dado que la mayoría de los genes que necesita para funcionar se han acabado trasladando al núcleo de la célula. Sin embargo, todavía retiene unos 16.500 pares de letras que codifican información genética para producir proteínas esenciales que necesita la mitocondria para seguir generando energía. Naturalmente, una mutación en cualquiera de estos genes mitocondriales tiene consecuencias devastadoras para la vida de la persona que herede tal alteración genética. Por eso las enfermedades congénitas de origen mitocondrial, que son muy poco frecuentes (son enfermedades raras), son tan graves, mortales la mayor parte de las veces, con unas manifestaciones patológicas muy complejas, que acaban afectando a prácticamente todos los órganos y las partes del cuerpo. Dado que la mayor parte de nuestras mitocondrias las heredamos a partir del óvulo (nuestras mitocondrias son esencialmente maternas) por eso las enfermedades congénitas mitocondriales son de herencia materna.
Las casi todopoderosas CRISPR, descritas inicialmente por Francis Mojica como un sistema de defensa que usan las bacterias para combatir los virus que las acechan, y convertidas por Emmanuelle Charpentier y Jennifer Doudna en verdaderas herramientas de edición genética, no pueden entrar dentro de las mitocondrias. Por eso las herramientas CRISPR no pueden usarse para editar el ADN mitocondrial.
David R. Liu, investigador del instituto BROAD en Boston sabía de las limitaciones de las CRISPR en mitocondrias y por eso se inventó una solución, acudiendo al sistema de edición genética anterior, las TALEN, derivadas también de bacterias que infectan a plantas. Las TALEN no necesitan ARN para identificar el gen a editar, como hacen las CRISPR. Las TALEN usan una parte variable de estas proteínas para aparearse con secuencias de ADN específicas. La N de las TALEN es la nucleasa del sistema, la que corta el ADN. Pero si solamente se usa la parte TALE (sin la nucleasa) esta proteína sirve para identificar una secuencia de ADN mitocondrial. Entonces solo hay que añadirle un módulo de deaminasa (como por ejemplo la citidina deaminasa) para crear unos editores de bases del genoma de las mitocondrias, que pueden cambiar una C por una T, un avance espectacular que describió Liu en 2020. Dos años después Liu mejoró estos editores mitocondriales relajando las bases que debían estar en las posiciones anexas a la que debía ser editada, convirtiéndolas en unas herramientas de edición del genoma mitocondrial mucho más versátiles. Liu también desarrolló editores de bases mitocondriales basados en otro sistema aún más anterior de edición genética: las proteínas asociadas a dedos de zinc.
Ahora todos estos conocimientos y extraordinarios desarrollos tecnológicos previos han permitido a unos investigadores de Utrecht (Países Bajos) utilizar los editores de bases TALE evolucionados de Liu para corregir, en modelos celulares y organoides, mutaciones patogénicas identificadas en el ADN mitocondrial de pacientes, explorando de forma pionera el uso clínico de estas nuevas herramientas de edición del genoma mitocondrial, para el tratamiento de enfermedades congénitas de origen mitocondrial.
Este trabajo, que se publica en la prestigiosa revista PLoS Biology, reporta dos tipos de experimentos, imposibles de realizar con CRISPR. En primer lugar, estos investigadores usaron estos editores de bases mitocondriales (llamados técnicamente DdCBE) para introducir una mutación específica en el ADN mitocondrial de células de un organoide de hígado (derivado de células pluripotentes inducibles humanas). Con ello comprobaron la reducción en la producción de energía y exploraron diferentes niveles de heteroplasmia, situación que se produce cuando en las células coexisten mitocondrias sanas y mitocondrias afectadas por la mutación.
En segundo lugar, y de forma quizá más relevante, los investigadores obtuvieron fibroblastos de un paciente aquejado de una de estas gravísimas enfermedades congénitas mitocondriales y usaron los editores de bases mitocondriales DdCBE para corregir la mutación (una T por una C en la posición 4291 del genoma mitocondrial), convirtiendo de nuevo la C en la T correcta y original, y restaurando con ello la funcionalidad de estas mitocondrias editadas.
En este trabajo los investigadores combinan el uso innovador de las versiones más evolucionadas de los editores de bases mitocondriales con las nanopartículas lipídicas, las que les permiten dirigir los editores a las mitocondrias, sin necesidad de usar vectores virales. Estos científicos también aplicaron métodos de última generación, de célula única, para analizar lo que sucedía en cada célula, dado que cada célula puede contener de cientos a miles de moléculas de ADN mitocondrial, comprobando que la eficiencia de modificación oscilaba entre el 0% y el 80%, con diferentes niveles de heteroplasmia (mezcla de mitocondrias intactas y editadas).
La última y sorprendente innovación que desarrollan estos investigadores es probar a introducir los editores de bases mitocondriales DdCBE no en forma de proteína sino en forma de ARN modificados, dentro de nanopartículas lipídicas, siguiendo el diseño que se inició con las vacunas anti-COVID19 y siguió con diversas propuestas terapéuticas que han seguido usando la administración de editores genéticos en forma de ARN. Y los resultados que obtuvieron fueron mucho mejores que administrando los editores de bases en forma de ADN. Finalmente el análisis de ediciones en otras secuencias no deseadas del ADN nuclear y del ADN mitocondrial (off-targets, fuera de la diana) produjeron resultados o bien no significativos (en el ADN nuclear) o algunos cambios inesperados (en el ADN mitocondrial) cuya relevancia correlacionaba con el porcentaje de edición en la secuencia seleccionada. Los posibles efectos deletéreos de estas mutaciones no deseadas deberán ser investigados en detalle.
Este trabajo es ciertamente relevante, pues abre las puertas a tratar las gravísimas enfermedades congénitas mitocondriales, hasta ahora incurables, mediante el uso combinado de diversas tecnologías de última generación,¡,
Gemma Marfany - crispr mitocondrias
Gemma Marfany
Catedrática de Genética de la Universitat de Barcelona (UB) y miembro de CIBERER
La terapia génica de enfermedades mitocondriales, que son de herencia materna, es difícil porque la entrada de ácidos nucleicos a la mitocondria está muy restringida. Eso hace que estas enfermedades, con mutaciones en el ADN mitocondrial, hayan quedado rezagadas en el diseño de terapias, ya que la estrategia de edición genética mediante el sistema CRISPR convencional no es posible porque el ARN guía no puede entrar en de la mitocondria. El interés del trabajo de estos investigadores es que han utilizado una estrategia alternativa que requiere solo la entrada de proteínas en la mitocondria. Han utilizado editores de bases derivados de una toxina bacteriana fusionados a proteínas TALEN que dirigen a los editores a secuencias concretas del ADN mitocondrial. Con esta estrategia han conseguido generar un modelo de enfermedad mitocondrial en organoides de hígado, y corregir hasta cierto punto fibroblastos de pacientes afectados por una enfermedad mitocondrial. Es también interesante que han comprobado que la entrega de las piezas necesarias para la edición de bases es más eficiente si se transfiere esta maquinaria mediante ARN modificado envuelto en partículas lipídicas, de forma muy similar a como se suministraron las vacunas de ARN para la COVID-19.
- Artículo de investigación
- Revisado por pares
- Estudio experimental
Indi P. Joore et al.
- Artículo de investigación
- Revisado por pares
- Estudio experimental